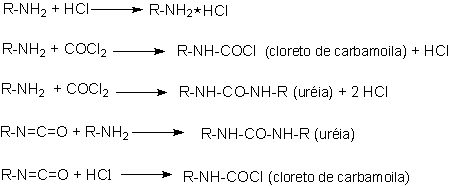
Wurtz foi o primeiro a sintetizar isocianatos pela reação de dietilsulfato e cianeto de potássio, em 1848. A primeira síntese de isocianato através da fosgenação de amina foi mencionada por Hentschel em 1884. Embora exista uma variedade de métodos para a síntese de isocianatos a fosgenação de aminas tornou-se o único método de importância industrial (Figura 1.10). Todos os isocianatos usados comercialmente têm ao menos dois grupos NCO por molécula que reagem com os polióis, água, extensores de cadeia e formadores de ligações cruzadas, formandos os PU's.
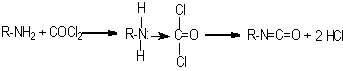
A reação é normalmente conduzida em solvente aromático clorado o que facilita a remoção do excesso de fosgênio e as etapas de purificação. O processo é complexo e envolve diversas reações laterais (Figura 1.11). Nas condições de fosgenação, o subproduto uréia é convertido em cardodiimida. Reações posteriores da carbodiimida com fosgênio forma um aduto contendo cloreto responsável pela presença de cloreto ao produto final.

Figura 1.11 – Reações laterais na obtenção dos isocianatos
1.2.3.1 - Tolueno diisocianato (TDI) - O tolueno diisocianato (diisocianato de tolileno) é normalmente comercializado como uma mistura dos isômeros 2,4 e 2,6 (Tabela 1.2) nas proporções 80/20 (TDI-80/20), 65/35 (TDI-65/35), ou puro (TDI-100). O TDI é um isocianato com funcionalidade igual a dois (f = 2,0) e apresenta maior reatividade do grupamento NCO localizado na posição 4 do anel aromático em relação aos grupos NCO nas posições 2 e 6.
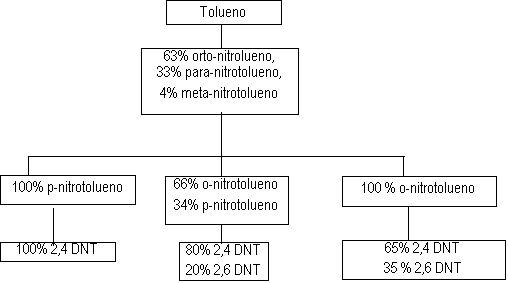
Figura 1.12 - Processo de fabricação de TDI
O processo de fabricação do TDI (Figura 1.12) consiste em sua primeira etapa na nitração do tolueno, com mistura sulfo-nítrica, e obtenção da mistura dos isômeros orto, meta e para nitrotoluenos. A separação dos isômeros é feita industrialmente por destilação fracionada. Quando somente o para-nitrotolueno é utilizado na segunda etapa da nitração obtemos o 2,4 dinitrotolueno (processo TDI-100). A nitração do orto-nitrotolueno, leva a obtenção da mistura de 65% do 2,4- e 35% do 2,6-dinitrotolueno (processo TDI-65/35). Se a mistura original é nitrada diretamente ou após remoção do meta-nitrotolueno, obtêm-se 2,4 e 2,6- di nitro tolueno na proporção 80:20 (processo TDI-80/20). A seguir, os dinitrotoluenos (DNTs) são hidrogenados a toluenodiaminas (TDAs) correspondentes. No processo, o hidrogênio é obtido do gás de síntese formado pela reação de reforma de hidrocarbonetos com vapor d'água. O nonóxido de carbono, também obtido do gás de síntese, reage com cloro formando fosgênio (COCl2) o qual reage com as TDAs dando origem aos TDIs correspondentes. As reações químicas envolvidas no processo de obtenção do TDI são mostradas na Figura 1.13.

1.2.3.2 - Difenilmetano diisocianato (MDI) - Os diferentes tipos de difenilmetano diisocianato (MDI) são os isociantos mais consumidos pelo mercado de PU. A química do MDI é mais complexa do que a do TDI e permite um significativo grau de liberdade aos químicos no sentido de modificarem e aperfeiçoarem tipos diferentes de MDI's para atender as especificações desejadas para o PU. Inicialmente o MDI foi desenvolvido para utilização nas aplicações em que a volatilidade do TDI causa problemas devido à toxidade e conseqüentes problemas de higiene industrial. A primeira etapa do processo de fabricação do MDI é a nitração do benzeno formando nitrobenzeno que é então hidrogenado formando anilina. A seguir ocorre a condensação da anilina com formaldeído, catalisada pelo ácido clorídrico, formando uma mistura de difenilmetano dianilinas (MDAs) contendo diferentes isômeros com dois ou mais anéis aromáticos. Posteriormente é feita fosgenação das MDAs formando o MDI cru (Figura 1.14).
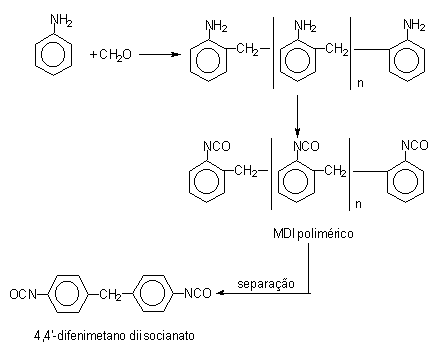
Figura 1.14 - Reações de obtenção do MDI
A mistura não destilada de MDI's, conhecida como MDI cru, ou MDI polimérico, possui funcionalidade média de 2,5 a 3,0 (Figura 1.15) e é composta dos isômeros 4,4'difenilmetano diisocianato, os 2,4' e 2,2', bem como dos produtos de condensação com mais de dois anéis aromáticos. Esta mistura é usada principalmente na produção de espumas rígidas onde provê significativas vantagens em processabilidade e desempenho mecânico, como resistência mecânica e estabilidade dimensional da espuma. O aumento da relação anilina/formaldeído aumenta a proporção de produto difuncional.
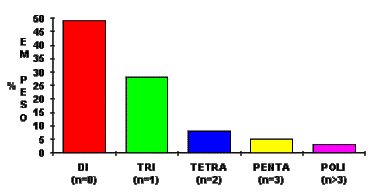
Figura 1.15 - Distribuição de funcionalidade do MDI
Tipos de MDIs - A rápida diversificação de novas aplicações levou ao desenvolvimento de uma variedade de produtos, que podem ser obtidos pela separação dos componentes da mistura de MDIs (Tabela 1.4). Estes MDIs apresentam uma grande variação de funcionalidade, viscosidade, teor de isômeros, etc. MDI's, produzidos sob medida, normalmente, têm uma funcionalidade efetiva menor do que 2,6 e um teor de diisocianato próximo ou maior do que 60%.
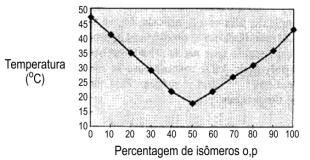
Figura 1.16 – Ponto de fusão de misturas de isômeros 2,4’ e 4,4’ do MDI
O MDI puro ou monomérico (isômero 4,4') é um sólido branco ou amarelado, com ponto de fusão de cerca de 38oC, que apresenta tendência de formar dímero insolúvel quando estocado acima de 40oC. Este fato, levou ao desenvolvimento de MDI's puros modificados que são líquidos à temperatura ambiente e apresentam pouca tendência a dimerizar. Os MDI's, com alto teor dos isômeros monoméricos orto e para (MDI 50 OP) (Figura 1.16), apresentam alta estabilidade durante a estocagem e não apresentam o comportamento do isômero monomérico p,p' de cristalizar na temperatura ambiente.
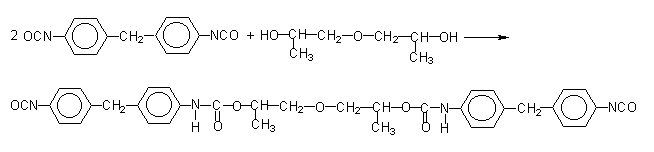
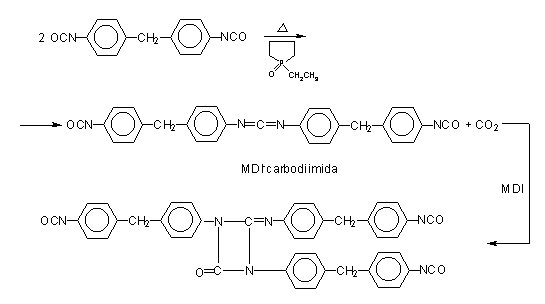
Outro método consiste em reagir MDI puro com um diol na proporção de 2/1 (Figura 1.17). Desta forma, obtém-se um diisocianato líquido, de maior peso molecular, com funcionalidade igual a 2. Este composto misturado ao MDI puro, resultan num MDI modificado líquido na temperatura ambiente. Outra forma é a conversão de parte do isocianato em carbodiimida, a qual reage com o excesso do isocianato para formar uretonimina. (Figura 1.18). Desta forma, obtém-se um diisocianato líquido, de maior peso molecular, porém, com funcionalidade igual a 3. Este composto misturado ao MDI puro resulta num MDI modificado líquido. O MDI modificado com carbodiimida (MDI MC) é um líquido estável, pouco viscoso, com funcionalidade média aproximada de 2,2 e ponto de fusão abaixo de 20°C.
Aplicações dos MDI's - MDIs puros são utilizados na produção de fibras e materiais elastoméricos de alto desempenho, enquanto os MDIs de maior funcionalidade são adequados ao uso em espumas rígidas e como ligantes. Entre estes dois extremos encontramos MDI's com composições e propriedades diferentes como: viscosidade, reatividade, estabilidade, processabilidade e formação de cristais (Tabela 1.4). MDI puro (isômero 4,4'), para fibra têxtil é obtido através de processo de separação fracionada e contém um teor muito baixo dos isômeros 2,4'. A extrema pureza e linearidade da molécula são critérios importantes para as boas propriedades na fiação e alta performance elastomérica da fibra obtida. MDI puro é também matéria prima na fabricação de prepolímeros para solados, adesivos flexíveis, revestimento de couro, poliuretanos termoplásticos, adesivos termo fundíveis, etc. Aqui o baixo teor de isômero 2,4' (máximo de 2,5%) é suficiente para que se obtenham as propriedades desejadas. Para atender a demanda em diferentes aplicações, uma variada gama de MDI's monoméricos é produzida, com tipos específicos de antioxidantes e a faixa de acidez modificada.
Tabela 1.4 – Aplicações dos MDI’s|
Funcionalidade |
Descrição |
Aplicações |
|
2,0 |
MDI puro |
Prepolímeros, adesivos flexíveis, fibras têxteis, elastômeros termoplásticos, solados, elastômeros de alto desempenho, revestimento de couro, selantes, etc. |
|
2,0 – 2,1 |
MDI puro modificado, MDI com alto teor de o,p Prepolímero de MDI puro |
Elastômeros moldados por vazamento, RIM, elastômeros, revestimentos e adesivos flexíveis, espumas microcelulares, etc. |
|
2,1 – 2,5 |
Poliisocianatos líquidos de baixa funcionalidade, mistura de isômeros, misturas com MDI cru |
Espumas flexíveis, semi-rígidas em peças automotivas para absorção de impacto, pisos esportivos, elastômeros moldados por vazamento, encapsulamento elétrico, etc. |
|
2,7 – 2,8 |
MDI polimérico de baixa viscosidade |
Espumas rígidas, espumas para isolamento térmico, aglomerante de raspas de madeira e em fundição, adesivos rígidos, pisos, etc. |
|
> 2,9 |
MDI polimérico de alta viscosidade |
Espumas rígidas de PU e poliisocianurato, espumas resistentes ao fogo para construção, etc. |
1.2.3.3 - Isocianatos alifáticos - Os PU's produzidos com isocianatos aromáticos mostram tendência ao amarelecimento sem perda das propriedades mecânicas. Todavia quando a manutenção da cor é um fator preponderante, como em certos revestimentos (Capítulo 7), os isocianatos alifáticos (Tabela 1.2) devem ser utilizados. Os diisocianatos alifáticos mais utilizados são o hexametileno diisocianato (HDI), o isoforona diisocianato (IPDI), o diciclohexilmetano diisocianato (HMDI) ou MDI hidrogenado, e o meta-tetrametilxileno diisocianato (TMXDI) Os isocianatos alifáticos são menos reativos do que os aromáticos pois neles não existe o efeito ativador do anel aromático no grupo NCO (Capítulo 1.2.1.1). Substituintes volumosos próximos do sítio de reação diminuem a velocidade de reação. Assim os grupos NCO do IPDI que são ligados a átomos de carbono primário e secundário, possuem reatividades diferentes. O TMXDI é um isocianato terciário e devido ao impedimento estérico dos grupos NCO ligados a átomo de carbono: possui baixa reatividade, notadamente com a água, o que possibilita seu emprego em sistemas reativos dispersos em água (Capítulo 7); e inibe as reações de formação de grupos alofanato, biureto e isocianurato.
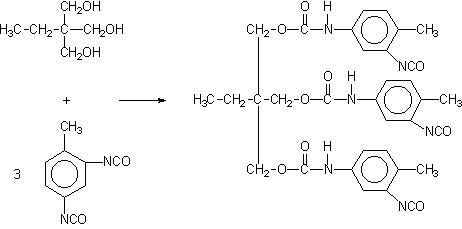
1.2.3.4 - Isocianatos modificados - Em aplicações como em formulações para tintas, revestimentos, adesivos, etc, é recomendado o uso de poliisocianatos com baixa pressão de vapor. Diisocianatos voláteis como o TDI, HDI e IPDI só são utilizados combinados quimicamente. Os isocianatos modificados menos voláteis e de maior peso molecular podem ser obtidos de diferentes formas como: a) pela reação de formação de adutos, com poliol e excesso de diisocianato; b) formação de biuretos; e c) trimerização para formar isocianuratos (Figura 1.20).
1) aduto TDI/trimetilolpropano
2) biureto de HDI
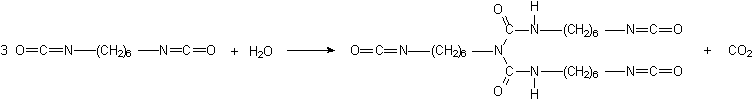
3) poliisocianurato de TDI
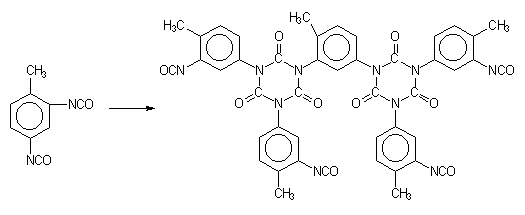
Por exemplo, um aduto de poliisocianato pode ser preparado pela reação do TDI com um álcool trifuncional, como o trimetilolpropano (Figura 1.20.1). O excesso do diisocianato, não reagido, é removido por destilação a vácuo, sendo a concentração final menor do que 1%. Isocianuratos, ou trímeros cíclicos (Figura 1.20.c), são fabricados a partir dos diisocianatos como TDI, HDI e IPDI. Misturas de poliisocianuratos de TDI e HDI são disponíveis comercialmente. Os produtos trimerizados comerciais contêm quantidades muito pequenas do diisocianato monomérico residual. Estes derivados possuem alta funcionalidade e baixa viscosidade. Os produtos comerciais são normalmente líquidos com: teor de sólidos de 50 a 100%, em solventes como acetato de etila, butila, ou metilpropila, xileno, ou nafta; e um teor de NCO livre de 4 a 22%, com base no poliisocianato puro; e viscosidades normalmente entre 1000 e 9000 mPa.s. Redução da viscosidade do trímero do HDI é possível pela redução da conversão, e os produtos com 95% de trímero puro, e menor peso molecular médio, possuem viscosidade menor que 1000 mPa.s.
Isocianatos hidrofílicos - Os isocianatos são hidrofóbicos por natureza. Para facilitar dispersão em tintas aquosas a base de dois componentes reativos, a compatibilidade do isocianato pode ser aumentada pela introdução de grupamentos hidrofílicos (Figura 1.20a). A forma mais comum é a introdução de grupos poliéter hidrofílicos, a base de óxido de propileno ou etileno, através da reação de um de seus grupos hidroxila com uma das funções isocianato. Estes grupos hidrofílicos podem ser não iônicos ou iônicos, se terminado num grupo específico que se dissocia em um determinado pH.
|
Isocianurato trímero do HDI |
Isocianurato trímero do HDI modificado com grupo hidrofílico (R) |
1.2.3.4 - Isocianatos bloqueados - Muitas das reações dos isocianatos são reversíveis, e este fenômeno permite a obtenção de isocianatos bloqueados, que regeneram a função isocianato por aquecimento. Os isocianatos bloqueados, normalmente são à base de TDI, HDI ou IPDI, podendo ser 100% sólidos ou dissolvidos em acetato de butila ou de 1-metoxi-propila, nafta, xileno, etc, com teor de sólidos entre 60 e 75%; com 3 a 10% de NCO livre; pesos equivalentes de 400 a 1400; e viscosidades de 500 a 40.000 mPa.s. São fabricados a partir de compostos que contêm hidrogênio ácido como o fenol, acetoacetato de etila e e-caprolactama. A faixa de temperatura necessária para o desbloqueio se situa entre 90 a 200°C, dependendo da estrutura do isocianato e do agente bloqueador. Os isocianatos aromáticos desbloqueiam-se em temperaturas inferiores à dos alifáticos, e a temperatura de dissociação decresce na seguinte ordem de agentes bloqueadores: álcoois > lactamas > cetoximas > compostos contendo grupamentos metileno ativos. Produtos como metiletilcetoxima (MEKO), dietil malonate (DEM) e 3,5-dimetilpirazol (DMP) são bastante utilizados. O DMP possui temperatura de desbloqueio entre 110-120°C, ponto de fusão de 106°C e um ponto de ebulição alto de 218°C, que faz com que ele não volatilize ocasionado problema na superfície do filme.
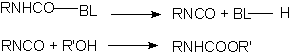 |
BL = composto bloqueador |
1.2.3.6 - Prepolímeros - Os PUs podem ser obtidos por processos em uma etapa, no qual todas as matérias primas são misturadas simultaneamente; ou processos em duas etapas, em que se faz a reação prévia do poliol, normalmente com excesso de isocianato formando um prepolímero com terminação NCO (Figura 1.21). O teor de NCO livre do prepolímero é dado pela relação isocianato/poliol (NCO/OH) utilizada. Quando a relação NCO/OH é muito superior ao dobro da estequiométrica, o produto resultante, denominado semi- ou quasi-prepolímero, possui grande excesso de isocianato livre não reagido, que aumenta a sua toxidade, e sofre restrições em muitas aplicações, principalmente com os isocianatos mais voláteis (Tabela 1.2). Na segunda etapa do processo ocorre a formação dos poliuretanos e poliuretanos/uréias de alto peso molecular pela reação dos prepolímeros terminados em NCO com dióis, diaminas, ou umidade do ar; e com os agentes de cura mais o restante do poliol, no caso dos quasi-prepolímeros.
|
|
Os prepolímeros são geralmente líquidos viscosos, fabricados em batelada em reatores agitados. Inicialmente faz-se a adição a frio do diisocianato e do poliol, nas proporções previamente determinadas para a obtenção do teor de NCO livre desejado. A reação é conduzida em atmosfera inerte e em ausência de água, na temperatura de no máximo 100oC para evitar a formação de ligações cruzadas alofanato e biureto (Capítulo 1.3.1). Para aumentar a estabilidade do prepolímero durante a estocagem adicionam-se estabilizadores ácidos como cloreto de benzoíla, cloreto de acetila ou ácido p-tolueno sulfônico. A presença de diisocianato não reagido aumenta a toxidade do produto e a sua remoção pode ser feita por destilação a vácuo.
Existem diversos tipos comerciais de prepolímeros, fabricados com os diferentes tipos de isocianatos e polióis, possuindo teores de NCO livre, variando desde os mais elevados (20%) utilizados nos sistemas para fabricação de elastômeros microcelulares para solados de sapatos (Capítulo 4.8), até os com baixos teores (1 a 2%) usados em selantes (Capítulo 7.2) e adesivos termofundíveis (Capítulo 7.1) curados com umidade do ar. As propriedades dos PUs dependem da natureza das matérias primas utilizadas, e assim PUs usados em espumas e géis hidrofílicos podem ser produzidos a partir de prepolímeros fabricados com poli(óxidos de propileno/etileno) glicóis (PPGs) (Capítulo 1.4.1) contendo teor elevado de óxido de etileno na cadeia. Por outro lado polióis hidrofóbicos como o PBLH (Capítulo 1.4.5) dão origem a PUs com características hidrofóbicas.
Em muitas aplicações, como nos elastômeros moldados por vazamento (Capítulo 6.2), a viscosidade dos prepolímeros, que depende da natureza química e do teor de NCO livre, é muito importante na processabilidade. Prepolímeros com maior teor de NCO livre possuem menor viscosidade devido ao menor peso molecular, e o efeito solvente do isocianato livre. A reatividade dos prepolímeros depende do isocianato utilizado e os fabricados com MDI são mais reativos. O TDI e IPDI, que possuem grupos NCO diferentes, formam prepolímeros que possuem o NCO menos reativo na extremidade. Isto minimiza a reação do prepolímero formado com poliol ainda não reagido (Figura 1.21), evitando a formação de macromoléculas com alto peso molecular, o que resulta numa distribuição mais estreita de pesos moleculares e menor viscosidade. Outro fator que acarreta aumento na viscosidade é a formação de ligações cruzadas alofanato, favorecida por temperaturas acima de 60-80oC, e catalisada por resíduos alcalinos, que podem estar presentes em polióis poliéteres. Prepolímeros, feitos com o TMXDI, possuem viscosidade bastante baixa devido ao impedimento estérico no grupo NCO ligado a átomo de carbono terciário, que impede a formação de ligações alofanato, mesmo quando processados em temperaturas de 125oC.